进展期胃癌治疗策略优化之路(一)
2015/5/9 医学论坛网

3月28日,中日胃癌治疗高峰论坛围绕着“优化进展期胃癌治疗策略”的主题在上海召开,北京大学肿瘤医院季加孚教授和沈琳教授、浙江大学医学院附属邵逸夫医院潘宏铭教授、中山大学附属第一医院何裕隆教授、中国医科大学附属第一医院徐惠绵教授、复旦大学附属肿瘤医院李进教授和上海交通大学医学院附属瑞金医院燕敏教授共同担任本次大会主席,多位中日两国的肿瘤内外科专家共同分析临床研究数据、分享临床治疗经验。


季加孚教授在开场致辞中指出,中日两国都是胃癌的高发区域,根据GLOBO CAN 2012统计数据显示,年龄标准化发病率和死亡率在中国和日本都为欧美国家的3~5倍。中日两国现共同面临如何提高胃癌诊疗技术,改善胃癌患者生存质量和延长胃癌患者生存时间的巨大挑战。需要不断增进中日间的学术交流合作,为胃癌综合治疗开拓新路径。
以S-1为基础的治疗方案,贯穿胃癌的全程管理

日本熊本大学医学院马场秀夫教授从胃癌全程管理的角度,全面解读了新版《日本胃癌治疗指南》(下称《指南》)。该指南是2014年日本胃癌学会(JGCA)在原版指南基础上进行的第4 版修订。更新要点包括晚期一线方案、辅助治疗方案和未来研究方向等方面内容。
晚期治疗对于晚期患者一线治疗方案选择,首先根据患者的人表皮生长因子受体2(HER2)状态进行分类。回顾对于HER2阴性晚期患者的治疗,多项研究证实了S-1用于胃癌晚期治疗的疗效。2014版《指南》基于既往SPIRITS研究和JCOG9912研究数据,推荐将S-1联合顺铂方案作为晚期胃癌患者的一线治疗方案。此外,START研究显示,与S-1单药对比,S-1联合多西他赛(DS)方案能延长晚期胃癌患者总生存(OS)期(12.5 个月对10.8 个月,HR=0.83,P=0.031),支持DS方案用于晚期胃癌患者的一线治疗。G-SOX研究对比了S-1联合顺铂(SP)或S-1联合奥沙利铂(SOX)的疗效。结果显示,两组患者生存无显著差异;但SOX组的不良反应,尤其是中性粒细胞减少性发热的发生率显著低于SP组,为晚期胃癌患者的一线治疗提供了新选择。对于HER2阳性患者,ToGA研究证实化疗基础上联合曲妥珠单抗能改善患者生存。HERBIS-1 研究中,S-1+顺铂+曲妥珠单抗的治疗方案取得了较高客观缓解率(67.9%)和疾病控制率(94.3%)。因此,《指南》推荐口服氟尿嘧啶类、铂类联合曲妥珠单抗方案一线治疗HER2阳性晚期胃癌患者。
辅助化疗 在胃癌辅助治疗方面,2007年《新英格兰医学杂志》公布的ACTS-GC研究数据显示,接受S-1术后辅助治疗患者的3年OS率为80.1%,而仅接受手术治疗者的3 年OS 率为70.1%,HR=0.68;2011年《临床肿瘤学杂志》公布的最终数据显示,患者5年OS率在S-1辅助治疗组和手术组分别为71.7%和61.1%,HR=0.669。基于该结果,《指南》推荐S-1术后辅助治疗方案。马场秀夫教授对ACTS-GC研究和CLASSIC研究结果进行对比后指出,S-1能降低术后患者腹膜转移和淋巴结转移的情况,而卡培他滨联合奥沙利铂(XELOX)能降低患者远处转移风险,但对腹膜转移风险无改善。可见,不同药物所对应的疾病干预类型不同,S-1对预防术后腹膜和淋巴结转移更为有效。另外,分析《指南》的未来发展趋势,马场秀夫对SOX一线方案、雷莫芦单抗二线方案以及氟尿嘧啶类联合铂类的辅助化疗方案提出预测。

中山大学附属肿瘤医院李宇红教授对胃癌个体化治疗现状进行了梳理。2014年5月,国际个体化治疗联盟推荐的胃癌个体化治疗靶点主要有以下3个,ERCC1低表达、针对5-氟尿嘧啶(5-FU)的二氢嘧啶脱氢酶(DPD酶)缺陷和胸苷酸合成酶(TS酶)过表达以及HER2。前两者因患者类型罕见临床意义较少,目前胃癌患者实际应用的个体化临床指标仅有HER2。胃癌个体化治疗的探索方向或可从以下两个方面展开:一是已作为很明确的靶点而被研发和临床所关注的方向,另一方面包括已被成功用于其他肿瘤的药物。这其中主要包括以下4类:MET抑制剂、免疫治疗、瑞戈菲尼及聚腺苷二磷酸核糖聚合酶-1(PARP1)抑制剂。在当前提出的“精准医疗”的概念下,还需多方力量共同努力,最终实现对疾病和特定患者进行个体化精准治疗的目的,提高疾病诊治与预防的效益。
胃癌腹膜转移的防治,S-1是代表性药物

上海交通大学医学院附属瑞金医院张俊教授通过对胃癌腹膜转移的诊疗难点、预防手段、治疗方案等进行梳理,探讨了腹膜转移胃癌患者的优化治疗策略。
胃癌腹膜转移主要面临以下3大临床难点。①发病率高。《欧洲外科肿瘤杂志》发表的一项研究结果显示,胃癌腹膜转移发生率较高。接近20%的胃癌患者在术前或术中即被诊断有腹膜转移;超过50%的胃癌患者在根治性切除术后发生腹膜转移。②早期诊断困难。腹膜转移以微转移为主,从腹腔内癌细胞存在到形成肉眼腹膜转移结节需6~8 个月。由于腹膜瘤结体积小、体积密度低,导致早期诊断非常困难。③生存期短,预后较差。有研究表明,腹腔冲洗液细胞学检查阳性患者的5 年OS 率仅为12.3%,腹膜转移胃癌患者的5 年生存OS 率仅为8.3%。如何解决腹膜转移这一难题?
当前,胃癌腹膜转移防治的关键就是预防。预防主要有3种手段。①外科手术中的无瘤技术。为防止因手术操作造成癌细胞医源性扩散,防止腹腔游离癌细胞的出现,应充分重视术中的无瘤观念及无瘤技术。②术中腹腔灌注化疗。一类是常温灌注,另一类是温热灌注。腹腔灌注可提高局部药物浓度,有效杀灭游离癌细胞。③术后辅助化疗。2000 年《英国外科学杂志》发表的一项大样本回顾性研究结果显示,年轻患者、弥漫浸润型、未分化型、浆膜侵润阳性、淋巴结转移、全胃切除等是术后腹膜转移的高风险因素(图1)。对于这部分腹膜转移的高危人群,应选择能抑制腹膜转移的有效辅助化疗方案。

5-FU药物是一类能通过腹膜血浆屏障的小分子量药物,然而由于腹腔内二氢嘧啶脱氢酶(DPD)的存在,5-FU穿过腹膜后会被迅速降解,从而无法达到有效药物浓度,而S-1由于包含DPD 酶抑制剂吉美嘧啶(CDHP),可有效阻止血浆、肿瘤及腹腔内5-FU 的分解,从而维持腹腔内有效药物浓度,可见S-1的药理学特性更针对腹膜转移。ACTS-GC 研究证实,Ⅱ/Ⅲ期胃癌患者在D2术后接受S-1辅助化疗可显著降低腹膜转移风险31%(表)。《欧洲外科肿瘤杂志》上的一项研究显示,腹腔细胞学阳性患者术后接受S-1治疗可改善生存,2年OS率从对照组的13.3%提高到47%。日本胃癌学会(JGCA)更新的胃癌治疗指南也推荐,对于实施了手术切除的腹腔细胞学阳性胃癌患者,优先推荐S-1单药辅助化疗。因此对于腹膜转移高风险患者,实施S-1辅助治疗将能有效控制腹膜复发转移,从而改善患者预后。

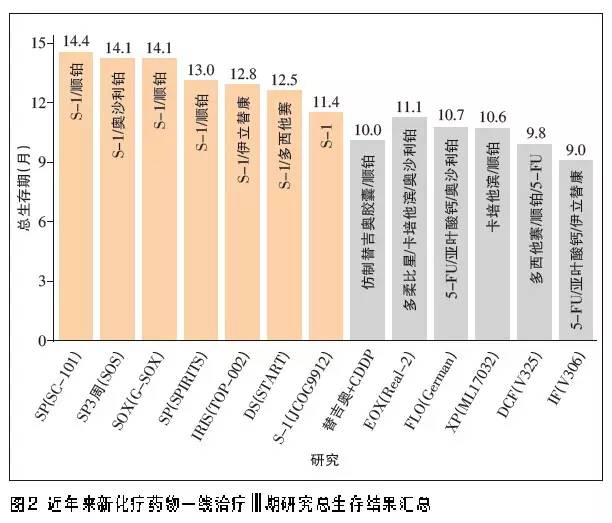
针对腹膜转移的治疗,日本一项小样本量研究证实,与5-FU静脉滴注治疗患者相比,口服S-1治疗者的生存期显著改善。新近SPIRITS、G-SOX、START 等多项Ⅲ期研究显示,S-1联合方案安全有效,显著降低腹膜转移患者死亡风险。S-1为基础方案治疗晚期胃癌Ⅲ期临床研究的生存期屡次突破1年,反映了其在东方人群治疗中的疗效和安全性优势(图2)。
此外,张俊教授介绍了日本东京大学对S-1联合紫杉醇治疗腹膜转移胃癌患者的尝试。该团队开展的一项Ⅱ期研究中,纳入40例晚期腹膜转移胃癌患者,给予紫杉醇联合S-1治疗;紫杉醇静脉注射50 mg/m2、腹腔注射20 mg/m2(第1 天、第8天),S-1口服80~120 mg/天(连续14天,间隔7天)。结果显示,接受该方案治疗的腹膜转移患者的1年OS率达78%,中位OS 期达22.5 个月。目前日本正在进行大型Ⅲ期PHOENIX-GC研究,旨在探究S-1联合紫杉醇对比S-1联合顺铂用于腹膜转移患者的疗效。该研究已入组完毕,结果将于今年底发表,相信该研究结果可进一步指导和优化腹膜转移患者的治疗方案。
未完待续,明日请看“进展期胃癌治疗策略优化之路(二)”
来源:中国医学论坛报 编辑:刘芊

http://weixin.100md.com
返回 医学论坛网 返回首页 返回百拇医药