Cell Metabol:抗衰老神药雷帕霉素在肝癌治疗中显示出前景
2019/2/4 22:34:40 世界医疗科技资讯
2019年2月1日一项刊登在国际杂志Cell Metabolism上的研究报告称,来自匹兹堡大学的科学家们通过对动物模型和患者组织进行研究鉴别出了肝脏中的一条新型的分子通路,研究者指出,一种常用的抗排斥药物或能被重新定向来治疗特定类型的肝癌。
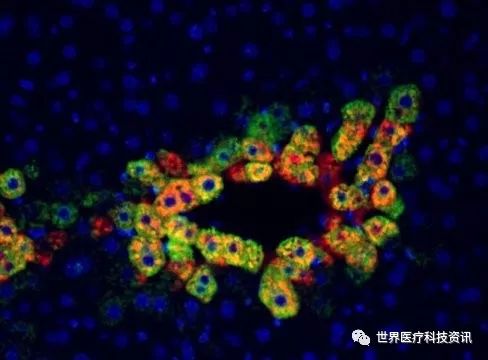
这些是小鼠肝脏组织,显示中央静脉周围的细胞,活性mTOR(红色)和谷氨酰胺合成酶(绿色)存在于相同的细胞中(黄色)。图片来源:Cell Reports /匹兹堡大学
“我们发现,β-catenin基因中具有特定突变的肝癌可能更容易受到雷帕霉素的影响,雷帕霉素是移植中常用的抗排斥药物,”病理学和创始人教授Satdarshan Monga博士说。皮特医学院匹兹堡肝脏研究中心主任和该研究的高级作者发表在细胞代谢中。“我们认为这为我们提供了一种新的精准医学方法,用于开发治疗肝癌的治疗方法,肝癌通常对治疗非常有抵抗力。”
目前的研究开始于Monga和他的团队偶然发现,中心静脉周围的细胞环(肝脏内的血管)显示出高水平的一种叫做mTOR的蛋白质。活性mTOR蛋白是一种细胞代谢中心的营养和能量传感器,在已知β-连环蛋白具有活性的相同细胞中被发现。
大约20%至35%的肝癌具有β-连环蛋白突变,但对于这些突变如何以及为何可以帮助癌细胞的生长几乎没有了解。因此,当Monga在β-连环蛋白突变的肝癌中发现类似的高水平活性mTOR时,他想知道这两种蛋白质是否可以在功能上相关联。
为了追踪mTOR激活的来源,科学家们创造了一种肝癌小鼠模型,在该模型中,它们与另一种名为Met的基因,特别是肝细胞中的β-连环蛋白进行遗传突变。这些小鼠患上的肝癌在遗传上非常类似于人类。
从增加的mTOR活化开始,他们跟踪这些小鼠中的分子面包屑,以显示β-连环蛋白通过称为谷氨酰胺合成酶(GS)的中间酶激活mTOR。这种分子途径与能量摄入有关,因为快速生长的癌细胞比正常细胞消耗更多的能量,显示出更高的GS和mTOR活性。
“我喜欢说这些肿瘤是mTOR成瘾的,”Monga说,他也是McGowan再生医学研究所和UPMC希尔曼癌症中心的研究员。“激活mTOR开启这些细胞中的蛋白质制造工厂,为他们提供分裂和成长的资源。”
当转基因小鼠喂食雷帕霉素 - 一种抑制mTOR的免疫抑制剂 - 肿瘤大小减小,当他们添加另一种抑制Met的药物时,肿瘤几乎完全被杀死,表明mTOR在帮助这些肿瘤生长方面发挥了重要作用。
研究人员指出,先前在肝癌患者中进行的一项临床试验未发现雷帕霉素有显着益处,但新发现表明,如果该试验仅限于β-catenin突变和mTOR成瘾肿瘤患者,那么一直比较成功。
“目前的肝癌治疗只能增加生存的可能性3或4个月,因此采用精确医学方法确定合适的患者可以让我们重新利用现有药物来提高治疗成功率,”Monga说。
除了治疗肝癌外,该研究还指出了一些方法可以降低一些肝移植患者的癌症复发风险。
“虽然移植患者使用雷帕霉素或不同的免疫抑制剂,但那些具有β-catenin突变和mTOR成瘾肿瘤的患者可能会受益于使用雷帕霉素作为首选的抗排斥药物。我们希望在不久的将来进行临床试验来测试雷帕霉素既可用于治疗肝癌,也可用于预防肝移植患者的复发,“Monga说。
由于市场上已经存在mTOR抑制剂,包括抗排斥药物雷帕霉素,他们想深入了解这些药物是否可以在肝癌中重新利用。因此,他们创建了一种肝癌小鼠模型,其中β-连环蛋白和MET基因发生突变,从而产生的肿瘤与人类中超过20%的肝癌相似。
当他们给老鼠喂食雷帕霉素时,肿瘤缩小了。皮特研究人员在《细胞代谢》杂志上报告说,当他们添加MET抑制剂时,癌症几乎完全消失。
之前在肝癌中已经尝试过抑制mTOR,但收效甚微。例如,在525名患有该疾病的患者中进行的2016年试验发现,肝移植后给予mTOR抑制剂西罗莫司的患者与接受不同类型抗排斥药物的患者的生存率差异不大。皮特研究人员认为,他们的结果主张采用更精细的方法,将mTOR抑制剂用于肝脏肿瘤同时具有β-catenin突变和mTOR蛋白成瘾的患者。
通过研究他们创造的肝癌小鼠模型,科学家发现β-连环蛋白使用一种叫做谷氨酰胺合酶的酶来激活mTOR。“激活的mTOR踢了蛋白质制造工厂在这些细胞中,给他们的资源分裂和生长,” 说资深作者Satdarshan艋舺,MD,病理学教授和主任皮特匹兹堡肝病研究中心在一份声明中。
雷帕霉素类似物已被批准并在市场上用于治疗一系列癌症,包括肾细胞癌和HER2阴性乳腺癌。mTOR抑制剂在肿瘤学市场上的拥挤可能促使阿斯利康最近决定放弃其中期候选人vistusertib,尽管有一系列癌症的数据很有希望。
至少,Pitt的Monga认为他的团队的研究结果证明了一种方法,即接受移植的肝癌患者被雷帕霉素作为首选的抗排斥药物而不是其他选择。
“目前的肝癌治疗只增加了3或4个月的生存可能性,因此采用精确医学方法确定合适的患者可以让我们重新利用现有药物来改善治疗成功率,”他说。
Pitt研究人员的下一步是计划一项临床试验,测试雷帕霉素作为肝癌的治疗方法,并作为预防接受肝脏移植的患者复发的一种方法。
研究者Satdarshan Monga说道,我们发现,β-连环蛋白基因发生突变的肝癌或许对雷帕霉素更加易感,而雷帕霉素是一种常用作器官移植过程中的抗排斥药物,这或许就能帮助研究者重新考虑雷帕霉素的新用途,利用其开发治疗肝癌(尤其是耐药性肝癌)的新型疗法。研究者指出,肝脏中中央静脉周围的一系列细胞中常常携带高水平的mTOR蛋白,mTOR蛋白作为对细胞新陈代谢非常重要的营养和能量传感器,其在β-连环蛋白处于活性状态的相同细胞中存在。
大约25%-30%的肝癌都携带β-连环蛋白基因突变,但研究人员并不是非常清楚这些突变如何以及为何会促进癌变细胞生长,因此当研究人员在β-连环蛋白基因突变的肝癌中发现高水平的活性mTOR时,他们就想知道是否这两种蛋白在功能上具有关联性。为了追踪mTOR激活的来源,研究者们开发了一种肝癌小鼠模型,使得小鼠机体中β-连环蛋白基因及名为Met的基因发生突变,随后研究者发现这些小鼠患肝癌的模式与人类非常相似。
当mTOR激活水平增加时,研究者通过对这些小鼠追踪后发现,β-连环蛋白能通过一种名为谷氨酰胺合成酶(GS)的中间酶类来激活mTOR,这些分子通路与能量摄入有关,作为快速生长的癌细胞,其往往能表现出更高活性的谷氨酰胺合成酶和mTOR。研究者Monga说道,这些肿瘤或许具有mTOR成瘾性,激活mTOR就能刺激细胞中蛋白质制造工厂的进程,从而给予癌细胞足够的能量分裂和生长。
当给遗传修饰的小鼠喂食雷帕霉素时,小鼠机体肿瘤的尺寸会下降,而当加入了另外一种抑制Met的药物时,肿瘤几乎被完全杀灭了,这就说明,mTOR在促进肿瘤生长上扮演着关键角色。研究者表示,此前在对肝癌患者的临床试验中并未发现雷帕霉素的明显有益效应,但本文研究结果表明,如果限定于携带β-连环蛋白突变和mTOR成瘾性肿瘤的患者,那么这种疗法或许会非常有效。
当前的干啊疗法能将患者的生存率增加3个月或4个月,因此采用一种个体化疗法来识别最合适的患者或许就能帮助重新定向当前的药物来改善癌症患者的治疗情况。除了治疗肝癌外,本文研究或许还能帮助研究者开发出新方法,有效减少接受肝脏移植的某些患者机体中癌症复发的风险。
最后研究者Monga说道,肝脏移植患者通常会给予雷帕霉素或一种不同的免疫抑制剂,利用雷帕霉素作为优先的抗排斥药物或能让β-连环蛋白突变和mTOR成瘾性肿瘤患者获益,后期我们还将继续深入研究检测雷帕霉素在治疗肝癌以及抑制肝脏移植患者疾病复发上的作用效果。相关研究由NIH该研究由美国国立卫生研究院拨款和德国研究基金会DFG至SFB 974资助。
期刊参考:
Adeola O. Adebayo Michael,Sungjin Ko,Junyan Tao,Akshata Moghe,Hong Yang,Meng Xu,Jacquelyn O. Russell,Tirthadipa Pradhan-Sundd,Silvia Liu,Sucha Singh,Minakshi Poddar,Jayvir S. Monga,Pin Liu,Michael Oertel ,Sarangarajan Ranganathan,Aatur Singhi,Sandra Rebouissou,Jessica Zucman-Rossi,Silvia Ribback,Diego Calvisi,Natalia Qvartskhava,BorisG?rg,DieterH?ussinger,Xin Chen,Satdarshan P. Monga。抑制谷氨酰胺依赖性mTORC1活化可改善由β-连环蛋白突变驱动的肝癌。细胞代谢,2019年; DOI:10.1016 / j.cmet.2019.01.002
原始出处:
Adeola O. Adebayo Michael, Sungjin Ko, Junyan Tao, et al.Inhibiting Glutamine-Dependent mTORC1 Activation Ameliorates Liver Cancers Driven by β-Catenin Mutations. Cell Metabolism, 2019; DOI: 10.1016/j.cmet.2019.01.002
http://weixin.100md.com
返回 世界医疗科技资讯 返回首页 返回百拇医药