真实世界证据(RWE):从“可有可无”到“不可或缺”
2020/5/20 18:00:49 石榴号

来源丨IQVIA艾昆纬咨询
RWE的时代已经到来

过去,真实世界证据(RWE)的定位主要是满足上市后与药物安全相关的监管要求。如今,RWE的应用已远远超出了药物警戒的范畴,被广泛应用于医疗健康行业的不同利益相关方,包括监管机构、卫生技术评估(Health Technology ssessment, HTA)机构、医保支付方和医疗从业人员(Healthcare professional, HCP)。曾几何时,医疗行业利益相关方对真实世界数据的精准度,以及RWE分析方法的不确定性存有疑虑,现如今实际应用中带来的价值已经让这些疑虑烟消云散。RWE的广泛应用与技术和医疗健康行业的数字化浪潮所驱动的统计分析创新紧密相关。
本白皮书将回顾不同医疗健康利益相关方(主要是欧洲)的RWE应用情况,着重说明RWE接受程度的差异和局限性。我们还将阐述影响市场动态的趋势,以及它们在近期内将如何变化。最后,我们提出了制药公司在RWE时代的应对战略。
制药公司内部也在越来越多的使用RWE。这些公司使用RWE为战略和运营决策提供信息,例如目标产品定位、临床试验设计、患者招募、财务预测或商务资源分配。
RWE应用场景越来越多

RWE处于不断发展中,并已广泛应用于药品上市前到上市后的整个生命周期。RWE也从最初的监管应用,扩展到满足不同医疗健康利益相关方,如医保支付方和HCP的特定诉求(见图1)。
图1:RWE的应用场景及利益相关方的诉求
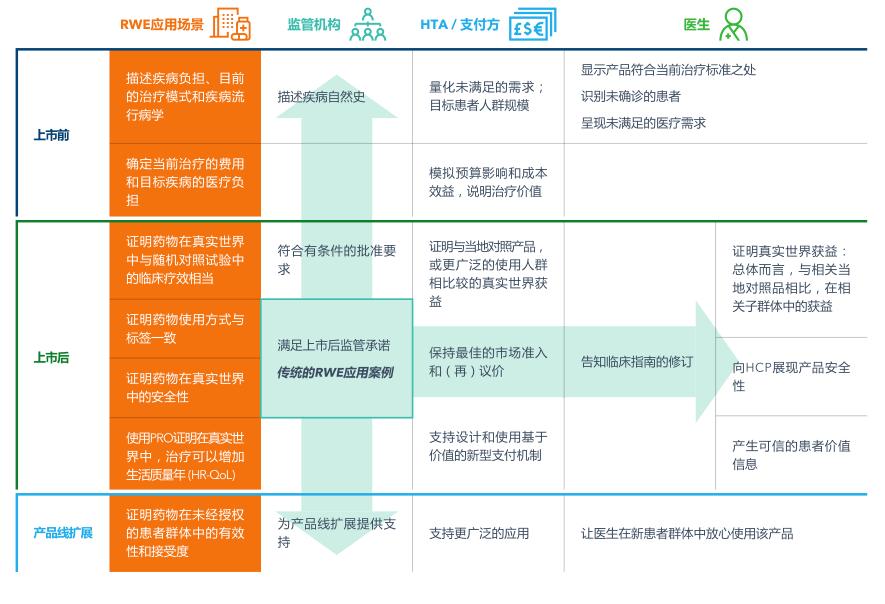
医疗创新影响规模之大,速度之快,导致医疗健康利益相关方面临的复杂性和不确定性都与日俱增,这也是RWE广泛运用的主要驱动力。监管机构和支付方很难理解在某些情况下的临床价值,并推断的医疗结果,用于加速或早期批准— 例如肿瘤产品的无进展生存期(PFS)、总生存期(OS)的外推结果,或缺少对比的单组试验的结果。同时,因治疗选择方案越来越多,患者群越来越细分,这使得医生越来越难以准确识别和定义患者,并准确诊断,给出最佳治疗方案。这时,RWE在消除不确定性和辅助医疗健康利益相关方的全面决策方面发挥着不可估量的作用。
为了进一步说明当今RWE的广泛应用,本文以表格形式介绍在产品生命周期的三个不同阶段中,各利益相关方应用RWE的案例:
1. RWE使监管变得便利
患者和医生都渴望创新治疗方法,为有未满足的医疗需求提供创新的解决方案。在此情况下,监管机构面临加快审批同时能确保新药安全有效的巨大挑战。为此,他们建立了便捷的监管途径,例如突破性疗法定义、快速审批和适应性许可,这些途径在监管机构批准时包含了更多不确定性,因此需要大量的上市后数据来验证初始评估。
RWE中的回顾性和前瞻性研究是使监管途径变得便利的关键推动因素。RWE能在日常临床实践中获取患者水平数据,使其成为监管机构判定药物安全性和有效性的首选证据。例如,欧洲药品管理局(European Medicines Agency, EMA)适应性途径试点项目的最终报告强调,“试点第二阶段接受的18项提案均包括计划使用RWE来补充随机临床试验,超出使用安全性注册研究的传统做法”。在此背景下,创新使用电子病历(EMR)尤其有用,特别是在电子病历的数据能关联医疗环境的情况下。
2. RWE方便市场准入利益相关方的早期沟通
RWE应用也正扩展到与HTA机构和支付方的早期沟通中。正如IQVIA HTA Accelerator数据显示,RWE目前在初始申报资料中的作用越来越重要:
在英国,提交给英国国家卫生与临床优化研究所(NICE)的初始申报资料中,RWE所占的比例在过去三年中稳步上升,从2015年的9%、2016年的22%,增加到2017年的37%
提交给法国国家卫生管理局(HAS)的初始申报资料中约有25%包括RWE
即使是对RWE持怀疑态度的德国,2017年也有一份初始G-BA申报资料中包括RWE,并获得了正面的评价
最重要的是,我们的分析还表明,包含RWE材料能带来更有利的HTA推荐。2017年,向NICE提交的初始申报材料中,包括RWE的只有12%得到负面推荐,而未包含RWE的则高达23%。在法国,2016年和2017年所有获HAS正面决定的初始申报资料中,不包含RWE的申报材料中11%有限定性条件,而包含RWE的则没有。
过去,RWE已被证明对解决疾病负担、未满足的需求、目标患者人群规模和临床价值的不确定性大有裨益。如今许多欧洲的HTA机构都针对真实世界数据(RWD)的来源制定了建议,并发布了适用性指南。与此同时,支付方越发意识到RWE在消除新疗法价值的不确定性,和减少潜在总成本负担方面的价值。
市场准入需要尽早纳入RWE。在IQVIA与一家公司开展的案例中,支付方并不了解某疾病领域。我们通过由10家医院组成的网络EMR数据库,涵盖5万多名患者,生成了强有力的真实世界证据。这些证据用于提高疾病意识,满足新型治疗方案的需求,从而使HTA成功申报。因此,在设计证据生成方法的过程中,支付方尽早的参与对确保HTA机构高度认可所提供的RWE至关重要。
在近期另一个关于乳腺癌新型疗法的例子中,药企在早期就与当地的HTA机构开展合作,以了解其全球临床试验项目产生的证据与当地HTA的要求之间可能存在的差距。具体而言,在没有总体生存(OS)数据的情况下,HTA机构仍可通过研究无进展生存(PFS)对生活质量(QoL)的影响,以确定药物对延缓病情发展的价值。此外,药企也了解了支付方针对特定目标患者群,对PFS数据推断出的OS结果所抱有的期望。据此,生产商制定了一个全面完整的策略来缩小证据差距,包括前瞻性的收集RWD、嵌入患者报告结果(PRO),以及与相关数据源所有者合作(例如,从乳腺癌登记处和专科癌症中心收集EMR数据),建立全欧洲RWE网络。
尽早与市场准入的利益相关方在获取证据的创新分析方法上达成一致的做法大有可为。最近一项大获成功的血液系统恶性肿瘤治疗案例充分证明了这一点。该产品通过确保支付方认可基于RWE,匹配、优化、间接比较的方法来证明结果的优效性,从而加速了欧洲市场的准入。
3. 与医疗卫生利益相关方共同制定临床实践指南
最近,根据一项对全欧洲医疗卫生利益相关方的调查显示,48%的受访者认为RWE“极有可能”或“非常有可能”改善临床指南的制定,另有33%的受访者认为这是“有可能的”。
同样,RWE的价值在于它来自真实世界的临床实践,从而克服了高度控制的随机对照试验在代表真实世界中患者群体和治疗方案的局限性。这为药企通过RWE与医疗卫生利益相关方共同制定临床指南提供了机会。欧洲呼吸学会特发性肺纤维化治疗指南(抗酸药物、双侧vs单侧肺移植指南),欧洲克罗恩病和结肠炎组织的治疗指南(克罗恩病患者长期使用硫嘌呤)等指南均参考了RWE证据。
除临床学会外,HTA机构在发布临床实践指南时也同样会纳入RWE。在英国,来自NHS临床实践研究数据链(CPRD)的真实世界数据已用于确认麻疹、腮腺炎和风疹的混合疫苗(MMR)的安全使用、为NICE癌症指南提供信息并用于改善糖尿病患者的高血压管理。
随着医疗卫生利益相关方对RWE越来越熟悉,他们能更好地了解RWE如何对传统随机对照试验数据、观察性研究和主要市场研究进行补充,从而坚定地将RWE作为他们信赖的证据组的一部分来指导其决策。
区域差异 – 现状和展望

医疗卫生利益相关方对RWE的青睐程度不一,且各国之间存在极大差异。这种地理差异在与市场准入相关的案例中尤为突出,见图2所示。
图2:欧洲五国市场准入决策中RWE的应用变化

如英国等最容易接受RWE的国家中,在RCT证据有限的情况下,他们愿意考虑由RWE证明的治疗效果,例如罕见病。在德国和西班牙等不接受RWE的国家中,市场准入利益相关方普遍对RWE证明治疗效果有所怀疑。他们仍通过随机对照试验获知临床疗效,但是通常将RWE用于流行病学、确定患者人群规模、明确疾病负担或了解当前的治疗标准等。
值得注意的是,相较于初始评估,欧洲五国更容易接受将RWE用于上市后再评估。
我们预计在未来五年内,市场准入的利益相关方对RWE的熟悉度和接受度将持续增长,从最初作为可选项,最终转化为基本要求来支持治疗效果。这一趋势不可阻挡。
据IQVIA采访的一位意大利支付方人员称,“一些正在施行的举措将提高RWE的质量,解决目前人们对其稳定性的担忧。因此,我们将看到在药企与意大利药品监管局的准入谈判中,RWE会在更广泛的范围内被视为临床和经济性方面的可靠证据。”
IQVIA访谈的几位西班牙支付方认为,“由于上市后再评估将成为强制性要求,并且还将包括药物经济学评价,所以RWE将更具影响力。然而,患者数据收集方式还需要改进,例如,通过疾病登记和更详尽的电子病历,以生成高质量的证据。”
在最近德国的一个案例中,RWE在证明治疗效果,获得支付方支持方面发挥了重要作用。作为德国医疗产品市场改革法案(The Act on the Reform of the Market for Medical Products, AMNOG)的一部分,一种高成本的专科药正在进行上市后再评估。在交付材料中,药企提交了对关键试验数据的重新分析,而在定价谈判期间,根据从德国各诊所提取的EMR数据进行的亚人群RWD特定研究进一步验证了专利药的优势。RWD分析侧重于真实世界应用和结果比较,并且证明了在产品标签包含的所有三个亚组人群中,相较对照药物的正面获益。该产品获得了正面获益评级,确保了所有相关人群能继续使用该药物,并避免了遵从参考定价。值得注意的是,该治疗领域的所有竞争对手随后都开始使用RWE以支持他们在德国的产品。
与此同时,法国市场准入利益相关方对RWE的应用越来越正式,如示例所示,所有最近的再评估都提供了RWE来支持竞争激烈的神经系统适应症药物的有效性和安全性。
有意思的是,小国(如荷兰或葡萄牙)通常比大国更热衷于接受RWE,并且在未来五年内,我们预计RWE将被列为指导定价和市场准入决策的证据组合中的“必备品”。
最后,除了应用在国家市场准入之外,从中期来看,随着相关RWD组织的建立(例如欧洲肿瘤数据协会,The ollaboration for Oncology Data in Europe, CODE),我们还期望RWE在欧洲实现地方准入时变得越来越重要,推动药企与区域或地方预算决策者签订特定适应症或基于价值的合同。
结论

随着RWE成为证据组合固定的一部分,以及进一步发挥为医疗卫生利益相关方的决策提供信息的作用,药企需要战略性运用RWE。这需要系统、协调的规划以及预测未来需求,同时确保组织灵活性和充分准备,并确保长期的RWE投资计划:
1. 综合证据策略
a. 全方位考虑RWE的潜在应用和机会
b. 深入了解已得到验证的利益相关方当前和未来的需求
c. 系统规划整个产品生命周期中证据的生成和使用,同时从早期开发阶段开始,预测公司内部不同部门的未来需求并做好准备,为证据生成提供充足的前置时间
2. 组织灵活性和准备充分
a. 无论是内部培养还是采取合作手段,确保具备关键资源,包括RWD、技术和技能型人才
b. 将组织上的各项因素落实到位,例如结果导向的流程、有效的管理以及正确使用RWE的思维方式
c. 确保RWE战略得到高层支持
3. 确保对RWE的长期投资
a. 制定长期的RWE投资计划,涵盖证据生成,确保组织准备充分
b. 将RWE投资需求纳入预算,并保证其持续性
4. 推动RWE的投资回报
a. 首先关注高优先级的技术支持
b. 避免纸上谈兵的思维模式
c. 通过整合特许经营/技术援助层面的证据生成计划来获取协同效应,避免重复工作
d. 通过证据平台及内部传播,例如,通过门户网站和有效的共享机制,实现证据流的生成和合理再利用
e. 在适用的法律体制内,将RWE有效地传达给医疗卫生利益相关方
RWE已得到发展并在持续地发挥作用。随着医疗卫生利益相关方逐渐接受并且切实的期望RWE作为指导决策的信息的一部分,药企在证据规划、生成和传递中必须战略性地纳入RWE。
通过巧妙运用并明智投资RWE,药企可以通过高效和协同效应来满足增量消费需求,同时从RWE投资中获得可观的回报。


新冠肺炎相关阅读
最新 | 关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知及解读
关于印发新型冠状病毒感染的肺炎诊疗方案(试行第五版)的通知及解读
新冠肺炎,多省中医药防治方案来了!
上海发布新型冠状病毒感染的肺炎中医诊疗方案北京市新型冠状病毒感染的肺炎防治方案(试用第一版)
广东省新型冠状病毒感染的肺炎中医药治疗方案(试行第一版)
新型冠状病毒感染的肺炎舌象辨证要点的专家共识!
上班后咋防控?权威指南来了!
国家卫健委发布新型冠状病毒防控指南(第一版)
关于印发《新型冠状病毒肺炎针灸干预的指导意见(第一版)》的通知

声明:文章图文均来源于网络,转载出于传播更多行业资讯之目的,不代表本公众号观点,如涉及侵权,请留言联系我方删除。

你点的每个赞,我都认真当成了喜欢
源网页 http://weixin.100md.com
返回 石榴号 返回首页 返回百拇医药