【盘点】28个“临床终止”的中国1类化药
2018/10/31中华小吃 药智网


如果您喜欢药智网推送的这篇文章
欢迎点赞和转发哦~
正所谓“失败乃成功之母”,每一个药物的诞生,大都伴随着成百上千甚至上万个失败化合物;从先导、到候选、再到IND、NDA,新药的创制,其过程步步维艰;尽可能地了解那些通过深入研究,最终却不得不面对开发失败的药物,也许会对我们在药物开发过程中,起到一丝警戒作用;故,笔者总结近年来28个“临床终止”的中国1类化药,希望大家能够有所启迪!
1. 28个“临床终止”的中国1类化药~简介
通过数据查询,中国1类化药,当前因种种原因而“临床终止”的品种,共28个;NDA状态3个品种,III期临床状态7个品种,II期临床状态5个品种,I期临床状态5个品种;简要信息见下表。

2. 28个“临床终止”的中国1类化药~逐一介绍
2.1 普拉地平~NDA
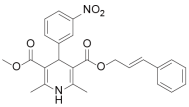
普拉地平由大冢研发,用于治疗心绞痛和高血压,2009年已在日本提交上市申请,但并无后期进展披露;该化合物于2007年分别由大冢制药申报进口临床研究和浙江大冢申报中国化药1.1类临床研究。最近相关事件:2008年以上两项申报均终止审批程序。
2.2 盐酸卡屈沙星~NDA

卡屈沙星,由UBE和第一三共研发,是一种DNA拓扑异构酶抑制剂,属于喹诺酮类,拟治疗细菌感染;曾在日本开展临床II期试验,但此项研究已于2002年终止;2003年,盐酸卡屈沙星葡萄糖注射液及盐酸卡屈沙星由江苏恒瑞申请的临床申请获CDE受理承办(1.1类化药);2009年,此药在中国申报注册上市,被列为特殊审评项目;2012年,要求提交补充材料以完成审评,后未见进展;2015年10月,在中国的注册审评终止。最近相关事件:2015年10月,在中国的注册审评终止。
2.3 人参皂苷Rd~NDA

人参皂苷Rd,是从中草药三七中提取的钙离子通道拮抗剂,拟静脉注射治疗急性缺血性中风患者,由广东泰禾医药科技有限公司与中山大学联合研发,后贵州信邦制药获得许可研发。该药曾于2010年9月在中国提交NDA申请(受理号为?CXZS1000033、CXZS1000034),而后于2013年 1月贵州信邦制药因新旧版本临床指导原则要求不同而主动撤回此申请,以组织开展项目调研和评估。公司根据当时调研和评估的综合结果判断人参皂甙 Rd仅需要重新开展临床III期研究即可重新申报,而后续经多方考虑于2017年3月终止此项目的研究及注册。最近相关事件:2013年,公司计划启动一项临床III期研究,后无更多进展,已终止研发。
2.4 羧胺三唑~3期

羧胺三唑由默沙东原研,后授权给美国国家癌症研究所(NCI)和RFE Pharma共同研发。该药曾处于用于治疗非小细胞肺癌和年龄相关性黄斑变性临床三期研究,以及治疗卵巢癌和前列腺癌的临床二期试验,但这些研究目前已终止。羧胺三唑胶丸(苏恩)在中国对非小细胞肺癌的临床III期研究,由中国医学科学院基础医学研究所和广东银珠集团有限公司开展,已于2014年终止。最近相关事件:2011年9月11日,随机、双盲、多中心羧胺三唑胶丸联合NP对照安慰剂联合NP治疗初治的Ⅳ期非小细胞肺癌患者(n=496)的Ⅲ期临床研究,在中国完成首例受试者入组。该研究由实际入组患者495例,于2014年10月31日终止。
2.5 拉洛他赛二水合物~3期
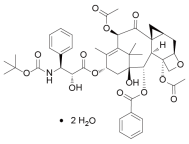
拉洛他赛和紫杉醇及多西他赛同为紫杉烷类药物,属于广谱抗肿瘤药物。其研发设计旨在解决紫杉醇的耐药性与微管蛋白变异,以及多西他赛的药物毒性反应问题。Sanofi-aventis(原Aventis)曾研发此药的注射剂型,拟用其治疗膀胱癌、胰腺癌,最高进入临床III期研究阶段,但此项目已于2010年终止研发。此药也曾开展乳腺癌临床III期研究,但也已于2009年2月终止。在中国振东制药等研发的拉洛他赛及拉洛他赛脂质微球注射液(莱龙泰素)已获临床批件(1.1类新药),用于既往接受过紫杉醇或多西他赛治疗方案的转移性乳腺癌患者,但后未见更多进展。最近相关事件:2014年8月,由振东制药与沈阳药科大学和无锡靶点药物研究有限公司在中国申报的临床获CDE受理,且于2015年12月获得临床试验批件,拟用于治疗既往接受过紫杉醇或多西他赛治疗方案的转移性乳腺癌患者。
2.6 盐酸莎巴比星~3期

盐酸莎巴比星是Menarini研发的蒽环类氨基二糖阿霉素类似物,属于拓扑异构酶II抑制剂,拟用于治疗实体瘤,包括小细胞肺癌(SCLC),曾处于SCLC的临床II / III期研究中,目前已终止。在中国由合肥合源药业有限公司和北京新沿线医药科技发展有限公司联合申报开展临床,后无更多进展报道。最近相关事件:2014年8月,注射用盐酸莎巴比星联合顺铂治疗小细胞肺癌(广泛期)安全性、耐受性及药代动力学Ⅰ期临床研究(CTR20150203)在中国完成首例受试者入组。
2.7 西夫韦肽~3期

西夫韦肽是天津扶素生物技术研发的HIV融合蛋白gp41抑制剂,结构与作用机制与恩夫韦肽类似,曾处于临床III期,用于治疗HIV感染,该研究已经终止。最近相关事件:2015年4月,注射用西夫韦肽不同给药间隔的安全性及药效学临床II期试验(CTR20150281)在中国完成首例受试者入组。
2.8 17-烯丙氨基格尔德霉素~3期

Tanespimycin由Kosan(被BMS收购)和NCI共同研发,用于治疗多发性骨髓瘤(MM)的研究曾处于临床II/III期,治疗乳腺癌和恶性黑色素瘤,曾处于临床II期, 但均已于2009年终止。该药也曾开展对甲状腺癌、慢性粒细胞白血病的临床II期研究。在中国17-烯丙氨基格尔德霉素由河北大安制药和深圳生尔易美生物技术共同申报中国化药1.1类临床研究,在获得临床批件后未见更多进展。最近相关信息:2009年12月,此药不在BMS研发管线显示,后经公司证实已终止其对MM、乳腺癌、恶性黑色素瘤的研发。
2.9 替托司特~3期

替托司特是由大冢制药研发的PDE4抑制剂,用于治疗慢性阻塞性肺疾病(COPD)曾多个地区看展临床二期阶段,因未能为后续三期研究提供充分的科学性数据,而于2016年3月而终止,而治疗溃疡性结肠炎(UC)、克罗恩病(CD)曾处于临床三期阶段,但CD、UC适应症已分别于2010年和2012年被停止研发。在中国,替托司特最初以进口1.1类申报临床,后由浙江大冢制药申报开展临床(1.1类新药),在获得批准后未见开展临床,而后再次由大冢制药株式会社以进口类型申报临床。最近相关信息:2010年3月,对CD的临床II/III期研究在日本、韩国进行。
2.10 曲沙他滨~3期
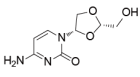
曲沙他滨最初由Shire研发,是一种具有非天然的L-构型的母核的核苷类似物,在前期的研究中发现,曲沙他滨对白血病、肺癌、肝癌、前列腺癌等多种癌症均有显着的疗效。同时它不会在可能造成耐药性的正常代谢(胞苷脱氨酶催化的去氨基反应)作用下失活,与传统抗癌药相比具有不易产生抗药性的优势。2004年授权予SGX Pharmaceuticals(2008年被礼来收购),曾经处于临床二/三期,用于治疗急性髓性白血病(AML),但在2006年终止。该药也曾处于用于治疗胰腺癌的临床二期,对慢性粒细胞白血病(CML)也有研究,但都在2002年之后未见更多进展。在中国,广西慧宝源医药科技正在研发曲沙他滨,目前对晚期实体瘤处于临床I期阶段(尚未招募)。最近相关信息:2017年3月,广西慧宝源医药科技有限公司计划启动曲沙他滨注射液的临床I期研究(CTR20161045、BCH-4556-101CN),以评估其用于晚期实体瘤患者的耐受性及药代动力学。至2018年10月,该研究显示尚未招募。
2.11 非洛他赛~2期
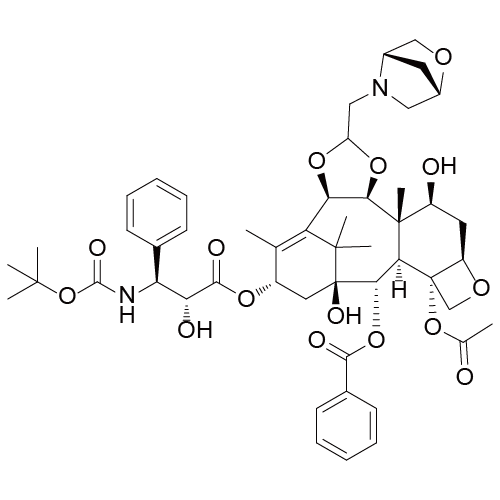
非洛他赛由江苏恒瑞研发,处于临床二期,用于治疗血液癌症与恶性肿瘤,包括结肠癌、肺癌和乳腺癌。2013年江苏恒瑞终止了对于该化合物的研究。最近相关信息:该化合物于2009年6月获得中国化药1.1类临床批件。
2.12 尼非韦罗~2期

尼非韦罗是一种治疗HIV感染的药物,但该项研究已被终止,而尼非韦罗用于预防艾滋病的研究正在进行。尼非韦罗最初由上海靶点药物研发,2006年授权于Avexa研发。最近相关信息:该化合物于2005年12月申报中国化药1.1类临床申请,于2007年2月获得临床批件。
2.13 酪丝缬肽~2期

酪丝缬肽处于临床二期,用于治疗非小细胞肺癌,目前对于该药物的研究已经终止了。最近相关信息:2005年2月,康哲药业(原名一泰医药)向中国食品药品监督管理总局提交临床试验申请(化药1类),2007年4月,获得获得临床试验批件。
2.14 二咖啡酰奎尼酸~2期
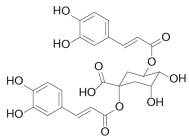
二咖啡酰奎尼酸处于临床二期,用于治疗HIV感染和乙肝,目前该药物的研究已经停止。最近相关信息:2004年8月,中国人民解放军军事医学科学院放射医学研究所联合江西江中制药(集团)有限责任公司向中国食品药品监督管理总局提交临床试验申请(化药1类),2005年11月获得临床试验批件。
2.15 醋酸烯诺孕酮~2期

烯诺孕酮最初由Population Council研发,分别于1997年授权给Elan Transdermal Technologies,2000年授权给Orion Pharma,2006年授权给Acrux。醋酸烯诺孕酮曾进行过治疗更年期综合症的临床二期研究。该化合物也曾进行过用于女性避孕的临床一期和治疗子宫内膜异位症的临床试验(临床阶段不明),但这些研究目前已终止。最近相关信息:2004年9月,浙江仙琚制药联合中国药科大学、中国科学院上海药物研究所、山东省医疗器械研究所向中国食品药品监督管理总局提交临床试验申请(化药1类),2005年8月5日获得临床试验批件。
2.16 马来酸海那替尼~1期

马来酸海那替尼处于临床一期,用于治疗恶性肿瘤,如肾癌或肠胃间质瘤、肺癌、肝癌、胃癌和其他实体瘤。2012年,海那替尼由于一期临床结果中安全耐受性存在不确定因素而停止研发。最近相关信息:2009年7月,江苏豪森、 江苏恒瑞和上海医药工业研究院向中国食品药品监督管理总局提交临床试验申请(化药1类),2010年6月24日获得临床试验批件。
2.17 托西酸西帕替尼~1期
托西酸西帕替尼由江苏豪森和上海医药工业研究院研发,曾进入临床一期,用于治疗肺癌和乳腺癌。2010年2月,中国食品药品监督管理总局受理该药的临床试验申请(化药1.1),2011年10月获得临床试验批件。最近相关信息:2012年,托西酸西帕替尼因生物利用度差、药效不明显而停止开发。
2.18 乌咪德吉~1期
乌咪德吉由恒瑞研发,处于临床一期,用于治疗癌症。2013年9月,该化合物获得中国1.1类临床批件。最近相关信息:2014年3月,恒瑞宣布终止乌咪德吉的研发,并寻求转让。
2.19 盐酸非那嗪奈~1期

该化合物最初由上海医药工业研究院研发,2005年转让给上海现代制药。盐酸非那嗪奈曾进入临床一期,用于治疗缺血性脑卒中。最近相关信息:2005年6月,上海医药工业研究院向中国食品药品监督管理总局提交临床试验申请(化药1类),2006年6月20日获得临床试验批件。
2.20 EDP-317~1期

EDP-317处于临床一期,曾进行过治疗实体瘤,白血病和血液系统癌症,但该研究目前已终止。该化合物由拜尔公司与ACT Biotech共同研发,于2014年授权给亿腾医药(研发代码EDP-317)。最近相关信息:2017年2月,亿腾药业(泰州)有限公司向中国食品药品监督管理总局提交临床试验申请(化药1类),2017年9月获得临床批件。
2.21 硫酸氢头孢地尼钠~IND

硫酸氢头孢地尼钠由浙江永宁制药和杭州奥默医药研发,用于治疗细菌感染。最近相关信息:该化合物于2010年3月由杭州奥默医药和浙江永宁制药共同申报中国化药1.1类临床研究,2010年11月审批完毕,审批结果不批准。
2.22 尼夫酰胺~IND
尼夫酰胺由上海富海科申药业有限公司研发,拟用于治疗艾滋病。最近相关信息:2004年11月中国食品药品监督管理总局受理本品的临床试验申请(化药1.1),2006年2月获得审评结果为退审。
2.23 果糖二磷酸镁~IND
果糖二磷酸镁由浙江浙北药业和南京工业大学研发,用于治疗心肌缺血并发症。该研究已被终止。最近相关信息:果糖二磷酸镁于2003年9月申报中国化药1.1类临床研发,于2004年9月退审。
2.24 古糖酯~IND

古糖酯是一种具有强聚阴离子性质的硫酸多糖类化合物,其电荷密度显著高于内源性的糖肢聚糖,而尿液中的糖胶聚糖是一种聚阴离子大分子电解质,具有抑制晶体生成、生长、聚集,防止晶体与细胞相互作用等多重功能。古糖酯由中国海洋大学研发,拟用于治疗尿路结石,目前无最新研究进展公布。最近相关信息:该化合物于2004年12月申报中国化药1.1类临床研究,2006年3月退审。
2.25 聚乙二醇降纤酶~IND
聚乙二醇降纤酶用于治疗血栓,由江苏正大天晴药业和上海医药工业研究院共同研发,该研究目前已终止。最近相关信息:聚乙二醇降纤酶2007年12月申报中国化药1.1类临床研发,于2008年7月审批完毕,审批结果不批准。
2.26 聚乙二醇化天花粉蛋白~IND
聚乙二醇化天花粉蛋白由安徽安科生物工程研发,用于治疗HIV感染和癌症,但该研究已被终止。最近相关信息:聚乙二醇化天花粉蛋白于2006年申报中国化药1.1类临床研究,2007年8月退审。
2.27 氯吲昔布~IND
氯吲昔布用于治疗类风湿性关节炎,但该研究已被终止。最近相关信息:2005年10月,中国医学科学院药物研究所联合江苏恒瑞向中国食品药品监督管理总局提交临床试验申请(化药1类),2008年8月退审。
2.28 乐福昔布~IND

乐福昔布由中国人民解放军总医院研发,用于治疗类风湿性关节炎。最近相关信息:该化合物于2006年9月申报中国化药1.1类临床研究,2009年7月审批完毕,审批结果不批准。
3. 小结
首先,从品种来源来看,上述药物大都来源于国外一些制药公司,且一些药物已知部分可能存在的问题,即并非好品种的引入;其次,从药物结构来看,以当前的审评标准来对待,许多结构是很容易产生基因毒的;再次,笔者通过进一步的查询,了解到,许多品种的终止开发,是源于公司内部的战略统筹,而并非单纯客观的药物属性开发失败,这就有些可惜了!建议读者可进一步了解上述药物开发失败背后的故事,那才是更加让人深思的,笔者只能点到为止,望谅解!
数据来源:药智数据
新闻来源:药智网
商务合作:183 2385 6316
157 3056 3797

声明
本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

http://weixin.100md.com
返回 药智网 返回首页 返回百拇医药