【药咖君】药审动态:临床急需新药、罕见病药上市获受理;帕金森病创新疗法美国上市;协和麒麟、拜耳、恒瑞、人福.....
2019/9/1 10:48:59 药智网

看点
1.10年磨一剑! 帕金森病创新疗法获FDA批准上市;
2. 研发超3000万,恒瑞新药终获美国上市批准;
3. 人福药业重磅首仿即将上市;
4. 临床急需新药布罗舒单抗上市申报受理;
5. 协和发酵麒麟的临床急需的罕见病新药申报上市;
6. 拜耳的上市遇阻药品再获上市受理。
FDA批准上市新消息
本周(8月23日至8月30日),FDA批准两重磅药品上市。分别是协和麒麟(Kyowa Kirin)株式会社开发的创新药Nourianz(istradefylline)。恒瑞医药的注射用达托霉素。
协和麒麟的Nourianz(istradefylline)
近日,美国FDA宣布,批准协和麒麟(Kyowa Kirin)株式会社开发的创新药Nourianz(istradefylline)上市,作为左旋多巴/卡比多巴的辅助疗法,治疗经历“关闭”期(“off” episodes)的帕金森病(Parkinson’s disease, PD)成人患者。
Istradefylline是一种口服给药的选择性腺苷A2A受体拮抗剂,可选择性阻断腺苷A2A受体,减缓多巴胺能神经元的退行性病变,且副作用小,可作为左旋多巴类药物的辅助治疗手段。
值得注意的是,协和麒麟早在2007年已向美国FDA递交这款新药的上市申请,然而没有获得批准。坚持10余年不放弃。不抛弃后,终于在近日获得FDA批准,有望帮助改善PD患者的生活质量。
恒瑞医药的注射用达托霉素
今日,恒瑞医药发布企业公告,其公司的新药注射用达托霉素获美国FDA批准上市。

达托霉素为环脂肽类抗生素,适应症为治疗成人复杂性皮肤和皮肤组织感染(cSSSI)、成人血液金黄色葡萄球菌感染。
达托霉素是由Lilly(礼来)公司最初研究,Cubist制药公司开发的环脂肽类抗生达托霉素,是近四十年来继恶唑烷酮类抗生素后应用到临床的唯一新结构类别抗生素,临床主要用于治疗复杂性皮肤及皮肤软组织感染与金黄色葡萄球菌引起的菌血症。应病人对新型耐药抗生素的迫切需求,2003年9月,美国FDA经过优先审批程序首次批准注射用达托霉素(商品名为Cubicin?),目前注射用达托霉素已在全球广泛上市销售。
经查询,国外除Cubist制药公司外,包括恒瑞医药已有12个公司的注射用达托霉素产品获批上市。国内已有Cubist制药公司的注射用达托霉素获准进口,商品名为Cubicin?,规格为0.5g。另,华东医药、海正药业及恒瑞医药的达托霉素原料药及注射用达托霉素已获批上市。
据IMS数据库,2018年达托霉素全球销售额约为8.7亿美元,美国销售额约为6.8亿美元。截至目前,恒瑞医药在该产品研发项目上已投入研发费用约为3,007万元人民币。
审评审批新动态
本周16个报生产药品受理号(10个品种)办理状态更新。其中审批完毕的有3个品种,“在审批”的有7个品种。
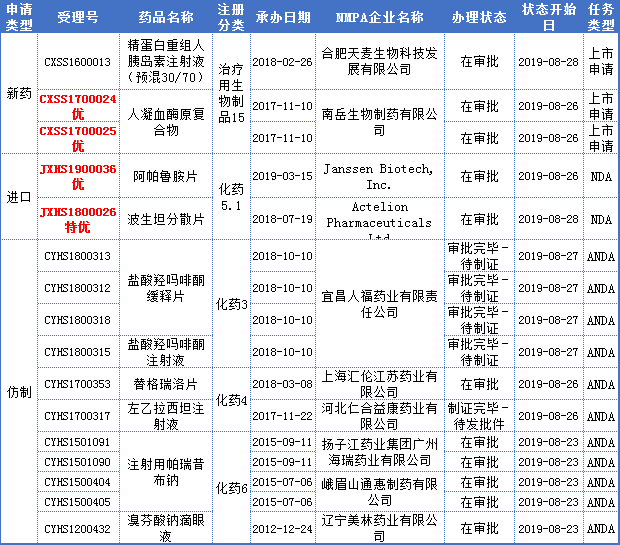
重点关注即将获批生产的宜昌人福药业的盐酸羟吗啡酮。
盐酸羟吗啡酮是吗啡的衍生物,为为阿片受体激动剂,具有极强的镇痛作用,临床上常用的麻醉剂;多用于创伤、手术、烧伤等引起的剧痛,也用于心肌梗死引起的心绞痛,还可作为镇痛、镇咳和止泻剂。
盐酸羟吗啡酮由Penwest公司和Endo公司共同研制开发,1982年1月1日 FDA 批准其注射液上市,商品名OPANA;2006年6月22日FDA批准片剂和缓释片,商品名OPANAER。
据药智药品注册与受理数据库,盐酸羟吗啡酮目前暂无国产和进口,同时仅有华素制药和宜昌人福制药申报注册,其中华素制药的该产品还在临床阶段,此次,宜昌人福获批,必将首仿上市。

审评审批新受理
本周CDE新承办报生产药品受理号16个,14个品种;值得关注的是协和发酵麒麟的布罗舒单抗注射液、拜耳的氯化镭[223Ra]注射液。

协和发酵麒麟的布罗舒单抗注射液
布罗舒单抗注射液为临床急需的罕见病新药,用于治疗FGF23 相关低磷血症。这是FDA批准的首个获批治疗1岁及以上儿童和成年人的X连锁低磷血症(XLH)的药物,位列第二批中国临床急需境外新药名单中。
布罗舒单抗注射液2017年7月在国内申报临床,并已优先审评快速获批,现申报上市,预计不久也会被纳入优先审评审批之列,快速上市。
拜耳的氯化镭[223Ra]注射液
氯化镭[223Ra](商品名Xofigo)一种α-粒子辐射放射性治疗药物,由拜耳开发,2013年05月15日FDA获批上市用于伴骨转移症状的趋势抵抗前列腺癌患者。
据行业预测,Xofigo的销售峰值可达15亿美元,但是2017年全球销售额为4.08亿欧元,2018年为3.51亿欧元,出现下滑。
据药智注册与受理数据库显示,此前,2018年11月23日,拜耳向NMPA递交了一氯化镭[223Ra]注射液受理号(JXHS1800063)上市申请,获优先审评和特殊审评,然而今年5月17日,拜耳前列腺癌该品种中国上市遇阻,CDE显示已经审批完毕,已发件,未能获得批准。现该品种再次申报获受理,能否一举拿下,拭目以待!
部分信息参考:企业公告,FDA官网
数据来源:
往期回顾
【药咖君】药审动态:喜讯!中美双报创新药临床均获批;扬子江、广生堂、药明康德重磅1类药新进展;潜力大品种抗癫痫药...
【药咖君】药审动态:1类新药罗沙司他,进口帕妥珠单抗注射液“制证完毕”;扬子江奋战百亿市场,来那度胺上市获受理;还有...
新闻来源:药智网
商务合作:183 2385 6316
188 8318 9653

声明
本文系专栏内容,观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

文章转载、入群交流,可添加小编微信(微信号:meng-xiran),即刻开启合作之旅!
打卡!2019
点个“在看”,让我住进你的心里

http://weixin.100md.com
返回 药智网 返回首页 返回百拇医药